Катедра по молекулярна фармакология и физиология, Медицински колеж Morsani, Университет на Южна Флорида, Тампа, Флорида, САЩ
Катедра по молекулярна фармакология и физиология, Медицински колеж Morsani, Университет на Южна Флорида, Тампа, Флорида, САЩ
Катедра по молекулярна фармакология и физиология, Медицински колеж Morsani, Университет на Южна Флорида, Тампа, Флорида, САЩ
Inbio Ventures, Москва, Русия
IBC Generium, Москва, Русия
Институт по фармакология на Закусов, Москва, Русия
Inbio Ventures, Москва, Русия
Катедра по молекулярна фармакология и физиология, Медицински колеж Morsani, Университет на Южна Флорида, Тампа, Флорида, САЩ
Адресирайте кореспонденцията и заявките за повторно отпечатване до д-р Хавиер Куевас, Катедра по молекулярна фармакология и физиология, Медицински колеж на Университета в Южна Флорида, 12901 бул. Брус Б. Даунс, MDC ‐ 9, Тампа, FL 33612‐4799, САЩ. E-mail: [email protected] Потърсете още статии от този автор
Катедра по молекулярна фармакология и физиология, Медицински колеж Morsani, Университет на Южна Флорида, Тампа, Флорида, САЩ
Катедра по молекулярна фармакология и физиология, Медицински колеж Morsani, Университет на Южна Флорида, Тампа, Флорида, САЩ
Катедра по молекулярна фармакология и физиология, Медицински колеж Morsani, Университет на Южна Флорида, Тампа, Флорида, САЩ
Inbio Ventures, Москва, Русия
IBC Generium, Москва, Русия
Институт по фармакология на Закусов, Москва, Русия
Inbio Ventures, Москва, Русия
Катедра по молекулярна фармакология и физиология, Медицински колеж Morsani, Университет на Южна Флорида, Тампа, Флорида, САЩ
Адресирайте кореспонденцията и заявките за повторно отпечатване до д-р Хавиер Куевас, Катедра по молекулярна фармакология и физиология, Медицински колеж на Университета в Южна Флорида, 12901 бул. Брус Б. Даунс, MDC ‐ 9, Тампа, FL 33612‐4799, САЩ. E-mail: [email protected] Потърсете още статии от този автор
Резюме
Използвани съкращения
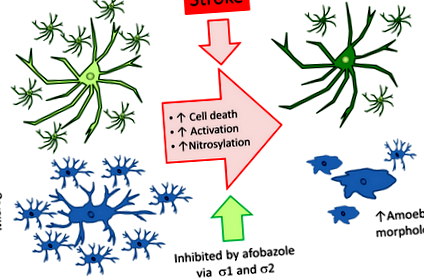
Представените тук данни показват, че активирането на афобазол на σ1 и σ2 рецепторите е отговорно за увеличеното оцеляване на глиалните клетки и запазването на тези клетки в състояние на покой след исхемичен инсулт. Инхибирането на σ1 или σ2 блокира ефектите на афобазола, което показва, че действията върху двата рецептора са необходими за глиозащитните и противовъзпалителни ефекти на това съединение. Доказано е също, че афобазолът намалява нитрозативния стрес 96 часа след инсулт, но не намалява значително повишенията на TNF-α, които се появяват в тези късни моменти от време.
Материали и методи
MCAO хирургия
Всички процедури и протоколи за боравене с животни са извършени с помощта на Ръководството на NIH за грижа и използване на лабораторни животни и одобрено от Институционалния комитет за грижи и употреба на животните към Университета на Южна Флорида. За това проучване са използвани възрастни мъжки плъхове Sprague – Dawley с тегло 325–375 g (Harlan, Indianapolis, IN, USA). Използваните тук процедури за MCAO са идентични с тези, които сме описали по-рано (Katnik и др. 2014). Накратко, мозъчният кръвен поток се наблюдава с 500 µm оптична лазерна доплер сонда (Moor Instruments, Devon, UK) и софтуер MoorLAB. Средната мозъчна артерия беше запушена, като се използва 4 cm дължина на монофиламент (250 μm диаметър), вкаран през външната каротидна артерия и се счита за успешна, ако има ≥ 40% намаление на лазерния доплер сигнал. Животните, получаващи фалшиви операции, бяха третирани идентично с MCAO плъхове, с изключение на вмъкването на монофиламента.
Протоколи за лечение и събиране на тъкани
Плъховете се инжектират интраперитонеално с равни обеми или носител (физиологичен разтвор), или афобазол (3 mg/kg) с честота 3 × на ден, започвайки 24 часа след операцията. Инжекциите продължават в продължение на 3 дни, докато животните не бъдат умъртвени на 96 часа след инсулт. Животните с фалшива хирургия се инжектират с 3 mg/kg афобазол. Σ рецепторните антагонисти (BD 1063, 30 mg/kg; SM ‐ 21, 1 mg/kg) се прилагат само при MCAO животни и се дават самостоятелно като контрола или в комбинация с афобазол (3 mg/kg), започвайки от 24 h след инсулт. Животните бяха разпределени на случаен принцип за фалшива или MCAO хирургия и за групи след хирургично лечение преди операцията. На 96 h след операцията анестезираните животни бяха перфузирани чрез пункция на лявата камера, първо с 0,9% физиологичен разтвор и след това с 4% параформалдехид. Мозъците бяха отстранени, поставени в параформалдехид за 24 часа, уравновесени последователно в 20% и 30% захароза и разрязани замразени на криостат (30 μm) в короналната равнина.
Имунохистохимия
Реактиви и статистически анализ
Използвани са следните лекарства: SM ‐ 21 и BD 1063 (Tocris Bioscience, Ellisville, MO, USA). Афобазол е предоставен щедро от Masterclone. Статистическият анализ беше проведен с помощта на софтуер SigmaPlot 11 (Systat Software, Inc., Сан Хосе, Калифорния, САЩ). Различията се определят, като се използва или еднопосочна, или двупосочна анова, според случая, и методът на Holm-Sidak, използван за post hoc анализ. Разликите се считат за значителни, ако стр
Резултати
Афобазолът намалява смъртта и активирането на микроглиалните клетки след исхемичен инсулт
Доказано е, че афобазолът предпазва микроглията от апоптоза, предизвикана от инвитро исхемия (Cuevas и др. 2011б). Не е установено обаче дали афобазолът може да намали смъртта на микроглиалните клетки in vivo след исхемичен инсулт. Проведени са експерименти за определяне на ефектите на афобазола върху оцеляването на микроглиални клетки след инсулт, като се използва MCAO модел на плъх и имунохистохимия. Животните са подложени на фалшива или MCAO операция и след това са инжектирани или носител (физиологичен разтвор), или 3 mg/kg афобазол. Инжекциите започват 24 часа след операцията и продължават, докато животните не бъдат умъртвени 96 часа след операцията. Фигура 1 (а) показва представителни микрофотографии на мозъчни секции (Bregma -0,3), маркирани с използване на анти-CD11b антитяло. CD11b-положителни клетки бяха открити във всички тествани групи. Анализ на броя на клетките, открити в множество експерименти, показва, че броят на микроглиалните клетки, идентифицирани във всяка секция, намалява след MCAO, спрямо фиктивни контроли (Фиг. 1b). Въпреки това, приложението на афобазол след MCAO води до статистически значимо увеличение на броя на микроглиите в ипсилатералното полукълбо спрямо сравними участъци от лекувани с физиологичен разтвор MCAO животни (фиг. 1б).
Инвитро проучвания в нашата лаборатория също така показват, че афобазолът предотвратява активирането на микроглията в отговор на исхемично увреждане (Cuevas и др. 2011б). По този начин бяха проведени имунохистохимични експерименти, за да се определи дали приложението на афобазол намалява микроглиалното активиране 96 h след MCAO. При фалшиво третирани животни микроглията се появява предимно в разклонено състояние на покой (фиг. 1ai). След MCAO и лечение само с физиологичен разтвор, в ипсилатералното полукълбо на тези животни преобладава активирана микроглия с прибрани процеси (Фиг. 1aii). При плъхове MCAO, лекувани с афобазол, микроглията в разклонено състояние в покой се наблюдава с по-висока честота, отколкото при лекуваните с физиологичен разтвор MCAO животни (Фиг. 1aiii). Анализ на микроглиалното активиране в множество експерименти показа, че на практика няма активиран микроглиален фалшиви животни (фиг. 1в). За разлика от това, имало приблизително два пъти повече микроглия в активирано състояние, отколкото в състояние на покой при MCAO животни, третирани с физиологичен разтвор (Фиг. 1в). Инжектирането на животни с афобазол (3 mg/kg) значително намалява фракцията на активирания микроглиал с близо 50% спрямо животни, инжектирани с носител (Фиг. 1в).
След това бяха проведени експерименти, за да се оцени как афобазолът влияе както върху оцеляването, така и върху активирането на астроцитите след MCAO (96 часа след операцията). Сравнението на броя на астроцитите в ипсилатералното и контралатералното полукълбо беше направено, като се използва GFAP маркиране като маркер за тези клетки. GFAP-положителни клетки могат да бъдат наблюдавани в цялото ипсилатерално полукълбо както на фалшиви, така и на MCAO плъхове (фиг. 2а). След MCAO, региони, лишени от GFAP маркиране, често се наблюдават в зоната на инфаркт на лекувани с физиологичен разтвор плъхове, но такова отсъствие на GFAP маркиране е по-рядко при третирани с афобазол MCAO животни (фиг. 2а). Обобщените данни показват, че плъховете, третирани с фалшиви животни, имат сравним брой астроцити в ипсилатералното и контралатералното полукълбо в изследваните региони (фиг. 2б). MCAO доведе до статистически значимо,
40% намаление на относителния брой астроцити в ипсилатералното полукълбо на третирани с вехикулум животни (фиг. 2б). Лечението на животни с 3 mg/kg афобазол след инсулт предотвратява загубата на астроцити (фиг. 2б).
Като се има предвид, че активирането на астроцитите може да увеличи нараняването след инсулт (Wang и др. 2008), ние специално изследвахме как афобазолът повлиява активирането на тези клетки след това in vivo исхемия. Това е важно, тъй като индуцираната от афобазол цитопротекция, показана на фиг. 2б, може теоретично да увеличи броя на реактивните астроцити и по този начин да влоши резултатите от инсулт. Реактивните астроцити изразяват високи нива на GFAP по отношение на астроцитите в покой. Следователно нивата на този маркер са били използвани за идентифициране и сравняване на броя на реактивните астроцити с общия брой на астроцитите. Броят на реактивните астроцити е нисък при фалшиви животни, а съотношението на ипсилатерала към контралатерала е
1, което показва, че не е имало увеличаване на броя на реактивните астроцити в ипсилатералното полукълбо на тези животни (фиг. 2б). След MCAO имаше
6-кратно увеличение на броя на реактивните астроцити в ипсилатералното полукълбо спрямо контралатералното полукълбо на третираните с физиологичен разтвор животни. Това увеличение е статистически значимо (фиг. 2в). Въпреки че се наблюдава повишено регулиране на активирането на астроцитите при лекувани с афобазол MCAO животни, това увеличение е статистически по-малко, отколкото при плъхове, третирани с носител (фиг. 2в).
40% намаляване на микроглиалното активиране спрямо физиологичен разтвор (фиг. 4б). Когато обаче се прилага BD 1063 или SM-21, афобазолът няма значителен ефект върху микроглиалното активиране (фиг. 4б).
След това бяха проведени експерименти за определяне дали афобазолът намалява нитрозативния стрес след исхемичен инсулт. Тези експерименти са мотивирани от факта, че нитрозативният стрес е добре установен като ключов медиатор на нараняване при инсулт и наблюдението, че σ рецепторното активиране може да намали производството на NO след исхемичен инсулт (Goyagi и др. 2001). Както при TNF-α, много ниски нива на SNOC бяха открити в фалшиви мозъци както в контралатералното, така и в ипсилатералното полукълбо, като нивата и за двете полукълба са сравними (фиг. 5б). След MCAO имаше изразена,
5-кратно увеличаване на етикетирането на клетки за SNOC при третирани с физиологичен разтвор животни. Въпреки това, има> 60% намаление на нивата на SNOC, когато афобазол се прилага след MCAO, и това намаление е статистически значимо (Фиг. 5б). По този начин афобазолът намалява нитрозилирането след исхемичен инсулт, което е вероятно да намали увреждането на клетките. Докато афобазолът намалява нитрозативния стрес, не са открити промени в оксидативния стрес, както се посочва от окислително увреждане на ДНК, 96 часа след инсулт (Фигура S1b).
90% в сравнение с подходящия контрол (т.е. MCAO с BD 1063 и MCAO със SM-1, съответно) (фиг. 6в).
Дискусия
Основната констатация, съобщена тук, е, че σ агонистът, афобазол, намалява активирането на глиални клетки и увеличава оцеляването на тези клетки, когато се прилага в забавени моменти от време в модела на плъхове MCAO на исхемичен инсулт. Броят на микроглии и астроцити се е увеличил 96 часа след исхемичната инсулт в ипсилатералното полукълбо на MCAO животни, лекувани с 3 mg/kg афобазол, започвайки 24 часа след операцията. Освен това добавянето на афобазол запазва по-голям брой микроглии в покой, разклонено състояние и намалява броя на реактивните астроцити, експресиращи високи нива на GFAP. Ефектите на афобазола върху астроцитите и микроглията са инхибирани чрез съвместно прилагане или на σ1 антагонист, BD 1063, или на σ2 антагонист, SM ‐ 21, което показва, че активирането на двата σ рецепторни подтипа е необходимо за ефектите на афобазола. Освен това е установено, че афобазолът намалява нитрозилирането на протеини, но не намалява нивата на възпалителния цитокин, TNF-α, 96 часа след инсулт.
В допълнение към увеличаването на преживяемостта на микроглиалните клетки, прилагането на афобазол 24 часа след инсулт намалява значително активирането на тези клетки 96 часа след операцията. Известно е, че активирането на микроглията е основен фактор, допринасящ за исхемичното увреждане, и инхибирането на този процес е известно, че намалява увреждането от инсулт (Giulian and Vaca 1993; Yrjanheikki и др. 1998; Лий и др. 2005). По този начин, това намаляване на микроглиалното активиране от афобазол се очаква да подобри резултатите от инсулт. Инвитро експерименти по-рано демонстрираха, че афобазолът блокира активирането на микроглиалните клетки, както е видно от намаляването на мембранното разрохкване и миграцията на клетките в отговор на АТФ (Cuevas и др. 2011б). По-рано нашата лаборатория показа, че агонистът на σ рецептора, DTG, намалява микроглиалното активиране инвитро и след MCAO (Ajmo и др. 2006; Зала и др. 2009). За разлика от това, лигандът σ1, SA4503, не успява да предотврати активирането на микроглиални клетки след исхемичен инсулт (Ruscher и др. 2012).
50%. Това може да обясни защо в по-ранни моменти от време след инсулт, преди смъртта на глиалните клетки, активиране на σ рецепторите от PRE-084 понижени нива на TNF-α.
В заключение, комбинираното активиране на σ1 и σ2 рецептори от афобазол води до увеличаване на оцеляването на микроглии и астроцити и намалява броя на реактивните глиални клетки след исхемичен инсулт при плъхове. Ефектите на афобазола зависят от активирането на двата рецепторни подтипа, като инхибирането на двата рецептора значително притъпява ефектите на това лекарство. Защитата на глията и намалената реактивност настъпва, когато приложението на афобазол започне 24 часа след инсулт, което показва, че афобазолът може ефективно да разшири терапевтичния прозорец за лечение на инсулт. Афобазолът също намалява нитрозативния стрес чрез активиране на σ1 и σ2 рецептори, което вероятно ще осигури ползи след инсулт. Изглежда обаче, че афобазолът не влияе на нивата на TNF-α, IL-10 или окислително увреждане на ДНК 96 часа след инсулт. Взети заедно, нашите открития дават представа за молекулярните механизми, чрез които афобазолът осигурява защита от нараняване на инсулт в забавени моменти от време и допълнително предполагат, че афобазолът има значителен потенциал като ново средство за лечение на инсулт при хора.
Благодарности и оповестяване на конфликт на интереси
Благодарим на Nivia Cuevas, R.Ph., за коментари по проект на този ръкопис и на Gabriel A. Cuevas за съдействието при SNOC имунохистохимични експерименти. Този ръкопис е подкрепен с безвъзмездни средства от IBC Generium за JC. Няма конфликт на интереси, които да бъдат докладвани за работата, представена тук.
Всички експерименти бяха проведени в съответствие с насоките ARRIVE.
- Загубата на телесно тегло увеличава концентрациите на плазма и мастна тъкан на потенциално токсични замърсители
- Дефицитът на мозъка 5-HT предотвратява антидепресант-подобни ефекти на диета с високо съдържание на мазнини и блокове
- Бубновски; s метод 15 секунди за активиране на имунната система - Яжте правилно!
- Купете Afobazole®
- Купете Fabomotyzol Afobazole таблетки 10 mg 60 бр. - Онлайн аптека