Мики Игараши
1 Катедра по приложна биологична наука, Висше училище по земеделие, Токийски университет по земеделие и технологии, Fuchu, Токио, Япония
Мику Моримото
1 Катедра по приложна биологична наука, Висше училище по земеделие, Токийски университет по земеделие и технологии, Fuchu, Токио, Япония
Асука Суто
1 Катедра по приложна биологична наука, Висше училище по земеделие, Токийски университет по земеделие и технологии, Fuchu, Токио, Япония
Акихо Накатани
1 Катедра по приложна биологична наука, Висше училище по земеделие, Токийски университет по земеделие и технологии, Fuchu, Токио, Япония
Тецухико Хаякава
1 Катедра по приложна биологична наука, Висше училище по земеделие, Токийски университет по земеделие и технологии, Fuchu, Токио, Япония
Кенджиру Хара
2 Fuji Nihon Seito Corporation, Shizuoka, Япония
Икуо Кимура
1 Катедра по приложна биологична наука, Висше училище по земеделие, Токийски университет по земеделие и технологии, Fuchu, Токио, Япония
Свързани данни
По отношение на наличността на данни беше предоставена следната информация:
Суровите данни са налични в допълнителните файлове.
Резюме
Заден план
Диетичните фибри, включително инулин, насърчават здравето чрез ферментационни продукти, като например късоверижни мастни киселини (SCFA), произведени от фибрите от чревната микробиота. SCFA оказват положителни физиологични ефекти върху енергийния метаболизъм, чревния имунитет и нервната система. По-голямата част от търговския инулин се извлича от растителни източници като корени от цикория, но може също така да бъде ензимно синтезиран от захароза, като се използват ензими, произвеждащи инулин. Изследвания, проведени върху гризачи, хранени с диета в кафенето, показват, че докато увеличава плазмената пропионова киселина, синтетичният инулин модулира метаболизма на глюкозата и липидите по същия начин като естествения инулин. Следователно, това проучване има за цел да определи ефектите на синтетичния инулин, Fuji FF, върху енергийния метаболизъм, производството на фекални SCFA и профилите на микробиота при мишки, хранени с диета с високо съдържание на мазнини/захароза.
Методи
Триседмични мъжки мишки C57BL/6J са хранени с диета с високо съдържание на мазнини/захароза, съдържаща целулоза или Fuji FF в продължение на 12 седмици и са оценени ефектите върху енергийния метаболизъм, производството на SCFA и профилите на микробиота.
Резултати
Повишаването на телесното тегло се инхибира чрез добавяне на Fuji FF при мишки с високо съдържание на мазнини/високо захароза, хранени с диета C57BL/6J чрез намаляване на теглото на бялата мастна тъкан, като същевременно се увеличават енергийните разходи, в сравнение с мишките, допълнени с целулоза. Fuji FF също повишава нивата на оцетна, пропионова и маслена киселини в изпражненията на мишки и повишава нивата на пропионова киселина в плазмата при мишки. Освен това, 16S рРНК генно ампликонно секвениране на фекални проби разкрива повишено изобилие на Bacteroidetes и намалено изобилие на Firmicutes на ниво филум при мишки, допълнени с Fuji FF в сравнение с тези, допълнени с целулоза. Fuji FF също доведе до изобилие от семейство Bacteroidales S24-7 и намаляване на Desulfovibrionaceae във фекалиите.
Заключение
Дългосрочната консумация на Fuji FF подобри чревната среда при мишки чрез промяна на състава на микробиотата и увеличаване на производството на SCFA, което може да бъде свързано с нейните ефекти срещу затлъстяването.
Въведение
Преобладаването на хората с наднормено тегло и затлъстяване се увеличава в световен мащаб заедно с това на метаболитни заболявания като захарен диабет тип II (T2DM), чернодробна стеатоза и няколко вида рак (Chooi, Ding & Magkos, 2019; Collaboration, 2017). Въпреки че се смята, че етиологията на затлъстяването включва сложна взаимовръзка между генетични и екологични фактори, диетата се счита за най-важния фактор, допринесъл за увеличената честота на затлъстяване и наднормено тегло (Chan & Woo, 2010; Chooi, Ding & Magkos, 2019) . Диетичният прием на мазнини се е увеличил поради увеличената консумация на преработени и бързи храни, тъй като приемът на диетични фибри, които могат да осигурят ползи за здравето, като намален риск от заболявания, включително затлъстяване и диабет, е намалял (Delzenne et al., 2020; Hadrevi, Sogaard & Christensen, 2017). Тези предимства на диетичните фибри се предоставят чрез нарушаване на усвояването на хранителните вещества в червата, докато полезните влакна се ферментират от микробиота. Диетичните фибри също могат да променят състава на микробиотата, за да намалят риска от заболявания, включително затлъстяване. Следователно, диетични фибри, които насърчават растежа на полезни микроорганизми в червата, се наричат пребиотици и консумацията им се препоръчва за поддържане на здравето на гостоприемника (Gibson et al., 2017).
Различни растения естествено произвеждат инулин, който е диетично влакно (Mensink et al., 2015), състоящ се от прави вериги от повтарящи се фруктозилови части, които са свързани с β (2 → 1) връзки с (1↔2) D-глюкозилова част в край (Mensink et al., 2015). Дължината на тези фруктозни вериги варира и степента на полимеризация (DP) обикновено е между 2 и 60 (Mensink et al., 2015). Инулинът е полизахарид, прилаган в хранителната, фармацевтичната и химическата промишленост поради уникалното му разнообразие от физикохимични свойства (Mensink et al., 2015). Натрупващите се доказателства подчертават значението на диетичните фибри за профилактиката и лечението на затлъстяването (Delzenne et al., 2020). Инулинът проявява пребиотични ефекти срещу затлъстяването, тъй като се ферментира до SCFA, особено маслена киселина, от чревната микробиота (Hoving et al., 2018). Изглежда тези ефекти зависят не само от диетичната доза, но и от DP на инулина (Van Loo, 2004). Разликите в DP също влияят на инулиновата ферментация и чревния регион, където се случва, и това променя състава на метаболитите и микробиома в чревните сегменти (Le Blay et al., 2003). Настоящите изследвания се стремят да разберат разликите в пребиотичните функции на инулина с различни DP или дължини (Le Blay et al., 2003).
Материали и методи
Проучване дизайн и експерименти
Измерване на енергийния метаболизъм и движение
Индивидуално настанени мишки в метаболитна камера бяха аклиматизирани за поне 12 часа между 9 и 11 седмици. След това измерихме VO2 и VCO2 с помощта на устройство MK-5000RQ и локомотивна активност, използвайки софтуера CompACT AMS ver.3 (и двете от Muromachi Kikai Co. Ltd., Токио, Япония). Системата се контролира при строг 12-часов цикъл светлина/тъмнина при атмосферни условия от 22 ° C и 30% –60% влажност. Измерванията продължиха най-малко 48 часа, включително периода на аклиматизация (≥12 часа) със свободен достъп до храна и вода. Дихателните коефициенти и енергийните разходи бяха изчислени въз основа на стойностите на VO2 и CO2, определени с помощта на MMS-4 версия 6.2 (операционен софтуер MK-5000RQ). Бяха извлечени непрекъснати 24-часови данни за дихателния коефициент, енергийните разходи и локомотивната активност. Измерихме енергийния метаболизъм и движението при 12 и 10 мишки, които получиха целулоза и Fuji FF, съответно, поради ограниченията на нашата система и времевите ограничения, наложени от експерименталната схема.
Количествено определяне на късоверижни мастни киселини
Анализ на фекална микробиота чрез секвениране на 16S rRNA ген ампликон
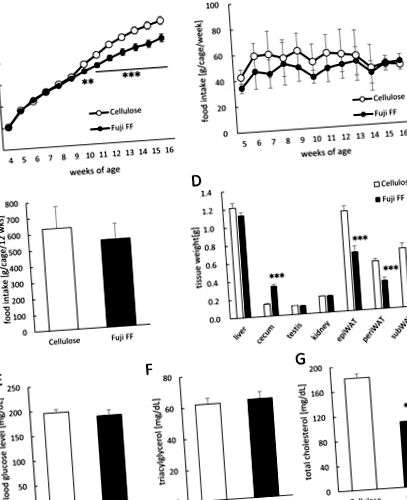
(А) Наддаване на телесно тегло. (B) Седмичен прием на храна (g/клетка/седмица; n = 9). (C) Общ прием на храна (g/клетка/12 седмици; n = 9). (D) Тегло на черния дроб, цекума, бъбреците, тестисите и белия епидидимен (epiWAT), периренален (periWAT) и подкожен (subWAT) мастни тъкани при мишки, хранени с диета с високо съдържание на мазнини/висока захароза, допълнена с целулоза или Fuji FF за 12 седмици. (E) Глюкоза в кръвта, (F) плазмен триацилглицерол и (G) плазмени стойности на общия холестерол, измерени при мишки след гладуване за 5 часа. Данните са изразени като средни стойности ± SEM (A, D, E, F и G) или като средни стойности ± SD (B и C). Значимостта се установява при коригирана р Фиг. 1). Коефициентът на дишане (RQ) е бил по-нисък през тъмния период при мишки, допълнени с Fuji FF, отколкото с целулоза (фигури 2А и andB; 2B; p = 0,0448, p = 0,0344, p = 0,0128 и p = 0,003 в 23:00) ч, в 00:00 ч, в 01:00 ч и съответно тъмните периоди), което предполага, че мишките, допълнени с Fuji FF, метаболизират повече мазнини, отколкото въглехидрати или протеини. От друга страна, мишките, допълнени с Fuji FF, изразходват значително повече енергия както в тъмния, така и в светлия период (Фиг. 2C и andDD; 2D; p = 0,006 в 08:00 ч, p Фиг. 2E и and2F; 2F; p Фиг. 3). Нивата на оцетна, пропионова и маслена киселини (Фиг. 3А, 3В 3В и и 3С, 3С, съответно) бяха значително повишени във фекалиите на мишките, допълнени с Fuji FF в сравнение с целулозата (p Фиг. 3Е) при мишките допълнено с Fuji FF (р = 0,039), докато оцетната (фиг. 3D) и маслената (фиг. 3F) киселини не са. По този начин Fuji FF увеличава чревното производство на SCFA чрез ферментация, което след това води до повишени плазмени нива на пропионова киселина, може би защото повечето SCFAs, произведени в червата, се метаболизират в черния дроб.
Fuji FF очевидно намалява натрупването на мазнини при мишки, като увеличава окисляването на мазнините и енергийните разходи, което се отразява от по-нисък RQ и повече енергийни разходи. По-специално, инулинът и олигофруктозата не влияят върху отделянето на мазнини в тънките черва на пациенти с илеостомия (Ellegard, Andersson & Bosaeus, 1997), въпреки че ефектът може да зависи от дозата фибри. Следователно, повишените нива на SCFA, индуцирани от Fuji FF, могат да бъдат основни модулатори на засиления енергиен метаболизъм, тъй като SCFA са ендогенни лиганди на G протеин-свързан рецептор (GPR) 41 и GPR43 (Kimura et al., 2011), които участват в много физиологични процеси, включително енергиен метаболизъм и неврологични функции (Kimura et al., 2014). Симпатиковите ганглии на мишки и хора по-специално изразяват обилен GPR41; по този начин, енергийните разходи и телесната температура могат да бъдат повлияни от SCFAs чрез GPR41, който регулира активирането на симпатиковата нервна система (Kimura et al., 2011). В допълнение, GPR43 се експресира в мастните тъкани, където контролира натрупването на мазнини. Фенотипът на мишките с дефицит на GPR43 е със затлъстяване, докато този на мишките, които свръхекспресират GPR43 в мастните тъкани, е слаб/нормален (Kimura et al., 2013). Необходимо е допълнително проучване, за да се изясни как тези рецептори участват в ползите за здравето на Fuji FF.
Заключения
Това проучване изследва дали синтетичният инулин, Fuji FF, може да предотврати развитието на диета, предизвикано от затлъстяване, като модифицира състава на чревната микробиота и производството на SCFA in vivo.
Нашите открития показаха, че Fuji FF има мощна способност да предотвратява затлъстяването, предизвикано от диета, като модифицира чревната среда чрез ферментация до SCFA при мишки. Потенциалната роля на SCFAs в действието срещу затлъстяване на Fuji FF инулин трябва да бъде допълнително проучена чрез оценка на техните ефекти върху GPR41 и GPR43 рецепторите.
- Роля на диетичните фактори в развитието на базално-клетъчен рак и плоскоклетъчен рак на
- Хранене на преживните животни, диетични фактори, влияещи върху развитието на стомаха на преживните животни от
- Безплатни пълни текстови разработки на база данни с етикети на хранителни добавки в Италия Фокус на FoodEx2
- Парадоксална резистентност към затлъстяване, предизвикано от диета с високо съдържание на мазнини и променена поляризация на макрофагите в
- Затлъстяване и риск от развитие на камъни в жлъчката при диета с 1200 kcald (5025 Kjd) - PubMed