Катедри по медицина, Медицински факултет на Университета в Индиана и Медицински център по въпросите на ветераните на Ричард Рудебуш, Индианаполис, Индиана 46202
Катедри по медицина, Медицински факултет на Университета в Индиана и Медицински център по въпросите на ветераните на Ричард Рудебуш, Индианаполис, Индиана 46202
Резюме
Отдавна се смята, че алкохолът причинява затлъстяване на черния дроб чрез променен NADH/NAD + редокс потенциал в черния дроб, който от своя страна инхибира окисляването на мастните киселини и активността на цикличните реакции на трикарбоксилната киселина. По-нови изследвания показват, че допълнителните ефекти на етанола едновременно влошават окисляването на мазнините и стимулират липогенезата. Етанолът пречи на ДНК свързващите и активиращите транскрипцията свойства на активирания от пероксизома пролифератор рецептор-α (PPARα), както е показано при култивирани клетки и при мишки, хранени с етанол. Лечението на мишки, хранени с етанол, с PPARα агонист може да обърне мастния черен дроб дори и при продължителната консумация на етанол. Етанолът също активира стерол регулаторен елемент, свързващ протеин 1, индуциращ батерия от липогенни ензими. Тези ефекти могат да се дължат отчасти на инхибиране на AMP-зависимата протеинкиназа, намаляване на плазмения адипонектин или повишени нива на TNF-α в черния дроб. Разбирането на тези етанолови ефекти осигурява нови терапевтични цели за обръщане на алкохолния мастен черен дроб.
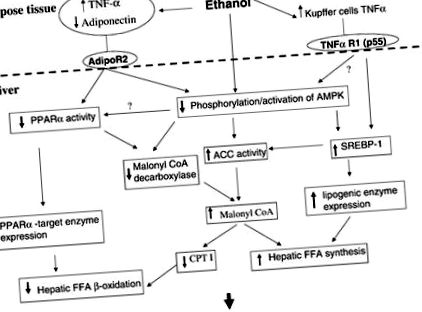
Фиг. 1.Потенциални механизми, лежащи в основата на алкохолния мастен черен дроб. Етанолът може да повлияе върху активността на активирания от пероксизома пролифератор рецептор-α (PPARα), стерол регулаторен елемент, свързващ протеин 1 (SREBP-1) и AMP-зависима протеин киназа (AMPK) директно или чрез ефекти върху адипонектин и TNF-α . Тези ефекти от своя страна активират липогенни пътища, инхибират пътищата на окисление на мастните киселини и увеличават концентрацията на малонил-КоА. Malonyl-CoA инхибира навлизането на свободна мастна киселина (FFA) в митохондриите и блокира окисляването на мастните киселини в митохондрията. CPT I, карнитин палмитоил-трансфераза; ACC, ацетил-КоА карбоксилаза; AdipoR2, адипонектинов рецептор 2; TNF-α R1, TNF-α рецептор 1.
Нивата на мастни киселини са значително повишени в черния дроб след консумация на алкохол; следователно би могло да се предвиди, че PPARα-контролираната батерия от метаболизиращи ензими ензими трябва да се индуцира от консумация на алкохол. Докато се съобщава, че подмножество от PPARα-реагиращи гени се индуцира от етанол, например цитохром P-450 4A1 (лаурил-хидроксилаза) и свързващ протеин на мастните киселини в черния дроб, много други не се променят или дори намаляват; например, средно-верижната активност на ацил-КоА дехидрогеназата и нивата на иРНК са намалени чрез подаване на етанол. Физиологичният резултат от увеличеното генериране на дикарбоксилни мастни киселини чрез повишена активност на лаурил-хидроксилаза и неуспеха на етанола да индуцира ацил-КоА оксидаза, първата стъпка в пероксизомното β-окисление, е повишената екскреция на дикарбоксилни мастни киселини в урината с алкохол хранени плъхове и при алкохолици. По този начин изглежда, че неуспехът на пълната индукция на метаболизиращи гени на мастни киселини при животни, хранени с алкохол, може да допринесе за развитието на мастен черен дроб.
Може би най-важните оставащи въпроси са: какво медиира ефектите на етанола върху тези транскрипционни фактори? Етанолът влияе ли на централна регулаторна система, която е отговорна както за намаляването на PPARα, така и за увеличаването на активността на SREBP-1, или това са резултатите от независими действия на етанола? Дали предотвратяването на затлъстяване на черния дроб, дори и при продължителна консумация на алкохол, би предотвратило по-тежките усложнения от алкохолно увреждане на черния дроб? Няколко нови потенциални клиенти, които могат да отговорят на тези въпроси, се появиха наскоро. Съобщава се, че етанолът намалява кръвното ниво на адипонектин, хормон, произведен в мастната тъкан, за който се съобщава, че активира PPARα и AMP-зависима протеин киназа (AMPK) и инхибира SREBP-1. Освен това се съобщава, че AMPK намалява експресията на SREBP-1 и инхибира ацетил-CoA карбоксилазата (ACC). Последният ефект ще намали нивото на малонил-КоА и ще увеличи скоростта на навлизане на мастния ацил-КоА в митохондрията. Този преглед ще изследва взаимодействията на етанола с тези регулатори на метаболизма на чернодробните мазнини и възможността за контролиране на мастния черен дроб чрез фармакологична намеса.
Етанолът инхибира транскрипционната активираща и ДНК-свързваща способност на PPARα и реакцията му към лиганди (клофибрат, WY14, 643), в хепатомни клетки или първични култури на хепатоцити, клетки с способността да окисляват етанол (7). Този ефект не се наблюдава при клетки, в които липсва алкохолна дехидрогеназа (ADH), което предполага, че за този ефект е необходим метаболизъм на етанол. Допълнителна подкрепа за тази хипотеза беше предоставена чрез показване, че ефектът на етанола е премахнат от ADH инхибитора 4-метилпиразол и увеличен от инхибитора на алдехид дехидрогеназата (ALDH) цианамид. Инкубацията на клетки с ацеталдехид (50–200 μM) също намалява способността на PPARα в ядрените екстракти да свързват ДНК. По този начин ацеталдехидът вероятно е отговорен за ефекта на етанола. Активността на няколко други ядрени рецептори (хепатоцитен ядрен фактор 4, аполипопротеин AI регулаторен протеин-1 и пилешки овалбумин нагоре по веригата промотор-транскрипционен фактор) не се влияе от етанола (7), което предполага, че това не е нито неспецифична токсичност на ацеталдехид, нито ефект на сигнални пътища надолу по веригата, споделени от ядрените рецептори.
За да се определи дали този ефект на етанола се проявява и in vivo, са проведени изследвания за хронично хранене с етанол (6). Четири седмици хранене с етанол доведоха до хистологично и биохимично натрупване на мазнини. Нивата на PPARα протеин са относително непроменени, докато нивата на RXRα са значително намалени. Това може да отразява ефекта на увеличения ендотоксин на порталната вена, тъй като се съобщава за намален чернодробен RXRα в отговор на ендотоксин (3). PPARα/RXR свързването с неговата консенсусна последователност също беше значително намалено (6). От контролираната от PPAR генна батерия, иРНК за ацил-КоА дехидрогеназа със средна верига е намалена с 40%, но тези, кодиращи ацил-КоА оксидаза, CPT I, много дълговерижна ацил-КоА синтетаза и много дълго верижна ацил-КоА дехидрогеназа са непроменени от протокола за подаване на етанол. Както се съобщава от други, чернодробният свързващ протеин с мастни киселини се индуцира от хранене с етанол.
Лечението на животните само с PPARα агонист WY14,643 през последните 2 седмици от експеримента доведе до индуциране на PPARα протеин ∼1,5 пъти, без промяна в нивата на RXRα, трикратно увеличение на свързването на PPARα/RXR с неговия консенсус ДНК последователност и нива на mRNA на много PPARα целеви гени (дълговерижна ацил-КоА дехидрогеназа, средноверижна ацил-КоА дехидрогеназа, ацил-коА оксидаза, много дълговерижна ацил-КоА синтетаза и протеин, свързващ мастни киселини) значително по-висока, отколкото при мишки, третирани с етанол.
WY14,643 третиране на животни през последните 2 седмици на хранене с етанол повишава нивото на PPARα протеин и способността му да свързва ДНК. Той също така индуцира нивата на тРНК на целевите гени PPARα и това е свързано с по-висока скорост на β-окисляване на мастните киселини, нормализиране на нивата на серумни FFA и триглицериди и обръщане на натрупването на мазнини в черния дроб. Ясно е, че непълно активиране на PPARα батерията от ензими по време на консумация на етанол допринася за развитието на алкохолно индуциран мастен черен дроб (6).
Окисляването на мастните киселини не се контролира единствено от активността на ензимите на β-окислението. Постъпването на мастна ацил-КоА в митохондрията се контролира от нивото на малонил-КоА, което е алостеричен регулатор на CPT I. Малонил-КоА се синтезира от АСС и се разгражда от MCD. Ролята на PPARα в регулирането на експресията и активността на ензимите, участващи в контрола на нивата на малонил-CoA, се обръща наскоро. Намалените скорости на окисление на мастните киселини в сърцата на PPARα (-/-) мишки са свързани с по-високи концентрации на малонил-CoA и намалената експресия и активност на MCD, което предполага, че PPARα може транскрипционно да регулира експресията на MCD (4). PPARα активиране (от WY14,643), но не и PPARγ активиране (от троглитазон), повишена експресия и активност на MCD mRNA в сърдечните и скелетните мускули (24). По-нататъшни проучвания демонстрират, че промоторът на MCD се активира 17 пъти в клетки, котрансфектирани с PPARα/RXRα експресионни плазмиди, и нивата на MCD mRNA в клетките на хепатома и в черния дроб на плъхове, хранени с фенофибрат, също са увеличени (12). По този начин инхибирането на функцията на PPARα от етанол вероятно би довело и до повишен malonyl-CoA и инхибиране на навлизането на мастни киселини в митохондрията.
По-нататък изследвахме ефекта на етанола върху SREBP-1 in vivo, използвайки стандартната течна диета, протокол за хранене по двойки. Храненето на мишки с диета с ниско съдържание на мазнини (4% масло от шафран, 6% какаово масло и 72% високо съдържание на въглехидрати) с етанол (27,5% от общите калории) в продължение на 4 седмици води до развитие на затлъстяване на черния дроб. Установено е значително увеличение на количеството зрял протеин SREBP-1 в черния дроб на мишки, хранени с етанол. Освен това, захранването с етанол увеличава експресията на иРНК на няколко известни SREBP-1 целеви чернодробни липогенни гени, включително синтаза на мастни киселини (FAS), стероил-КоА десатураза, ябълчен ензим, ATP цитратна лиаза и ACC, което показва, че индуцираната от етанол индукция на SREBP-1 узряването може да бъде свързано с увеличаване на експресията на тези гени (23). В съответствие с нашето откритие, Ji и Kaplowitz (9) съобщават, че храненето на мишки с диета с високо съдържание на мазнини (15,7% въглехидрати, 25% протеини, 35% царевично масло) с етанол (24,3%) в продължение на 6 седмици, използвайки интрагастрален инфузионен модел, приблизително удвоен SREBP-1 иРНК в продължение на 6 седмици и увеличава зрялата форма на SREBP-1 протеин. Взети заедно, тези проучвания предполагат, че продуктите от метаболизма на етанола могат да увеличат чернодробната липогенеза чрез активиране на чернодробния SREBP-1.
AMPK се появява като „метаболитен главен превключвател“, регулиращ пътищата на синтеза на чернодробни триглицериди и холестерол. Той фосфорилира и инхибира ензимите, участващи в липидния метаболизъм, като 3-хидрокси-3-метил глутамат-CoA редуктаза и ACC. АСС обикновено се разглежда като ограничаващ скоростта ензим в биосинтеза на мастни киселини и както беше обсъдено, неговият продукт, малонил-КоА, е мощен инхибитор на CPT I. AMPK е основната киназа, отговорна за инактивирането на АСС, а наскоро и съобщава се за активиране на MCD от AMPK (15). Следователно, активирането на AMPK се очаква да намали нивата на малонил-КоА, увеличавайки окисляването на мастните киселини.
Адипонектинът, наричан също 30-kDa свързан с адипоцитния комплемент протеин (Acrp30), е хормон, секретиран от адипоцитите. Адипонектинът с пълна дължина претърпява протеолитична обработка и малко количество глобуларен адипонектин (gAd) циркулира в плазмата. Миналата година бяха идентифицирани два рецептора за адипонектин, AdipoR1 и AdipoR2 (21). AdipoR1 е високоафинитетен рецептор за глобуларен адипонектин и нискоафинитетен рецептор за лиганд с пълна дължина, докато AdipoR2 е междинен афинитетен рецептор и за двете форми на адипонектин. AdipoR1 се експресира обилно в скелетните мускули, докато AdipoR2 се експресира предимно в черния дроб; следователно само адипонектин в пълна дължина е активен в черния дроб. Голяма работа показа, че намалените нива на циркулиращ адипонектин са свързани със затлъстяването, инсулиновата резистентност, диабет тип 2 и атеросклерозата, а приложението на адипонектин намалява аномалиите, свързани с метаболитния синдром. По-нататъшни проучвания разкриват, че ефектът на адипонектин е до голяма степен медииран от увеличаване на окисляването на мастните киселини, свързано с активиране на AMPK и PPARα пътища надолу по веригата на адипонектиновите рецептори, както in vitro, така и при животни (16, 21).
Оригиналното биохимично обяснение на алкохолния мастен черен дроб се фокусира върху способността на метаболизма на етанола да измества редокс състоянието на черния дроб и да инхибира окисляването на мастните киселини. Последващи проучвания установяват потискане на някои ензими, участващи в окисляването на мастните киселини и индуцирането на липогенни ензими при животни, хранени с етанол, но няма обединяваща хипотеза, която да обясни тези ефекти. Предполагаме, че ефектите на етанола върху липидния метаболизъм се дължат на инхибиране на PPARα и стимулиране на SREBP-1, което в резултат води до метаболитно ремоделиране на черния дроб към орган за съхранение на мазнини, а не към окисляване на мазнини. Тези ефекти от своя страна могат да се дължат на ефекти на етанола върху AMPK. Привлекателно е да се разглежда AMPK като централен модулатор на метаболизма на чернодробните мазнини, особено защото активността на AMPK е подложена на въздействието на етанола върху адипонектина и евентуално TNF-α (фиг. 1).
Предполагаме, че проксималните ефекти на етанола включват увеличаване на ендотоксина на порталната вена, производството на TNF-α в мастните и купферовите клетки и намаляването на циркулиращия адипонектин. Точно как етанолът влияе върху мастната тъкан е несигурно. В хепатоцитите по-ниският адипонектин би довел до намалена активност на PPARα и AMPK. Сигналните каскади между AdipoR2 и тези медиатори са неизвестни. Известно е, че TNF-α намалява експресията на PPARα в черния дроб. Ефектите на TNF-α върху AMPK не са известни и са актуална област от интерес в нашата лаборатория.
Инхибирането на AMPK чрез хранене с етанол води до увеличаване на активността на SREBP-1. В резултат на това целевите гени за SREBP-1 се регулират нагоре, допринасяйки за повишен чернодробен липиден синтез. AMPK инхибирането също води до повишена активност на ACC и намалена активност на MCD чрез промени в състоянието на фосфорилиране на тези ензими и по този начин би намалило скоростта на окисляване на мастните киселини чрез повишени концентрации на малонил-CoA. AMPK може също да повлияе на активността на PPARα. PPARα се активира в сърцето от p38 MAP киназа (2) и активността на p38 може да бъде намалена чрез инхибиране на AMPK активността (19). Намалената активност на PPARα ще доведе до намален капацитет за окисляване на мастни киселини и намалена експресия на MCD.
Тези изследвания върху генезиса на мастен черен дроб при животни, хранени с алкохол, поставят основата за по-нататъшно клинично изследване. Модулирането на тези сигнални пътища може да осигури нови и ефективни терапии за алкохолен мастен черен дроб и евентуално да предотврати възпалителните и фиброзни реакции на черния дроб към етанол.
Тази работа беше проведена с подкрепата на Националния институт за злоупотреба с алкохол и алкохолизъм AA-06434 (на D. W. Crabb), AA-013623 (на M. You) и P50-AA-07611 на Центъра за изследване на алкохола в Индиана.
СТЪПКИ
Разходите за публикуване на тази статия бяха покрити отчасти чрез плащането на такси за страница. Следователно статията трябва да бъде маркирана с „реклама”В съответствие с 18 U.S.C. Раздел 1734 единствено, за да посочи този факт.
Дължим на изключителния технически и интелектуален принос на Рут Ан Рос, Ян Зенг и Мичинага Мацумото.
- Регулиране на чернодробното възпаление от фолиева киселина при безалкохолна мастна чернодробна болест (NAFLD) - Sid
- Силимарин при безалкохолна мастна чернодробна болест
- Тежкото затлъстяване е свързано с тежестта на чернодробното заболяване при педиатричния безалкохолен мастен черен дроб
- Патогенеза и управление на алкохолна чернодробна болест - FullText - Храносмилателни заболявания 2016, том
- Безалкохолни мастни чернодробни заболявания (NAFLD) Симптоми, причини; Лечение