Fumiaki Nozawa 1,2, Mehmet Yalniz 1, Murat Saruc 1,3, Jens Standop 1,4, Hiroshi Egami 2 и Parviz M Pour 1,5
1 Eppley Institute for Research in Cancer and Allied Diseases. Омаха, NE, САЩ
2 Катедра по гастроентерологична хирургия, Висше училище по медицински науки, Университет Кумамото. Кумамото, Япония
3 Отдел по панкреатикобилиарни болести, Катедра по гастроентерология и хепатология, болница Acibadem, Harvard Medical International. Бакиркой, Истанбул, Турция
4 Катедра по хирургия, Rheinsche Friedrichi-Wilhelms-University. Бон, Германия
5 Катедра по патология и микробиология, Медицински факултет на Университета в Небраска. Омаха, NE, САЩ
* Автор-кореспондент: Parviz M Pour
Институтът на Eppley за изследване на рака и свързаните с него заболявания
Медицински център на Университета в Небраска
986805 Медицински център Небраска; Омаха
NE 68198-6805; САЩ
Телефон: +1-402.559.4495
Факс: +1-402.559.4651
Електронна поща: [имейл защитен]
Получено 4 юни 2012 г. - Прието 30 януари 2013 г.
Резюме
Ключови думи
Храносмилане; Диета, богата на мазнини; ДНК; Инсулин; Инсулинова резистентност; Островчета Лангерханс; Панкреатин
Съкращения
ABC: авидин-биотин-пероксидазен комплекс; BRDU: бромодезоксиуридин; хи, химотрипсин; FPE: гъбичен панкреатичен ензим; СН: високо съдържание на мазнини; LI: индекс на етикетиране
ВЪВЕДЕНИЕ
МАТЕРИАЛИ И МЕТОДИ
Животни
Използвани са осемседмични сирийски златни хамстери от колонията Епли. Те бяха настанени в централизираното съоръжение за сравнителна медицина за животни, Асоциация за оценка и акредитация на лаборатория за грижа за животните (AAALAC), международно акредитирано животновъдно съоръжение, в пластмасови клетки върху постелки от царевични кочани (Bed-O-Cobs, The Anderson Cob Co., Maumee, OH, САЩ) при стандартни лабораторни условия (температура: 21 ± 2 ° C; влажност: 40 ± 5%; цикъл светлина/тъмнина: 12 часа/12 часа; 10 пъти смяна на въздуха/час). Те бяха хранени с търговска диета (Wayne Lab Blox, Allied Mills, Чикаго, Илинойс, САЩ) и имаха свободен достъп до чешмяна вода.
Проблемът с вкуса на ензимите, дадени в питейната вода, беше решен чрез обучение на новородените хамстери, както се съобщава [1]. По този начин количеството вода, съдържащо FPE, консумирано от тези хамстери, не се различава от котилата, пиещи чиста чешмяна вода.
Гъбичен панкреатичен ензим (FPE)
Хидролитичните ензими, получени от микробни и растителни източници, имат дълга история на безопасна употреба в хранителната промишленост. Ензимите, които могат да се получат без рецепта, се използват като помощни средства за преработка в храната и всички те са присъствали в хранителните доставки преди 15 октомври 1994 г., изискване за тяхната употреба в хранителни добавки, без да се дава разрешение от FDA. FPE беше с любезното съдействие на Националната ензимна компания (Forsyth, MO, САЩ). След смилане на FPE, който се доставя под формата на люспи в тъканна чаша с ниска скорост, един грам от заземения FPE може след това да се разтвори във вода при 1:10 ml във вода от 4 ° C. Прясната партида, която се поддържа при 4 ° C веднага след доставката, се подменя на всеки три месеца. Консумацията на храна и вода (и ензими) се записва на всеки две седмици и концентрацията на FPE се коригира в зависимост от телесното тегло.
Известно е, че диетичните компоненти на търговската чау диета варират значително от партида до партида. Също така, той може да съдържа различни количества токсични продукти, включително фунгицид, пестицид, хербицид и др. За да се избегне възможната намеса на някои компоненти в търговската храна, която може да инактивира ензимите, използвахме полусинтетичните нормални и богати на мазнини диета, както беше съобщено по-рано [3, 4], приготвена прясно и съхранявана в хладната стая за не повече от две седмици.
Анализ на инсулина
Взети са кръвни проби преди лечението и две седмици след хранене на свински панкреатичен ензим и животните са умъртвени след 21 дни. Животните са гладували цяла нощ, преди да бъдат взети кръвни проби. Кръвта се събира в стандартни епруветки на Eppendorf, съдържащи 45 pL апротенин (Sigma Chemical Co, Сейнт Луис, Мисури, САЩ; l μg/ml) на ml кръв и 7,5 pg EDTA. Епруветките се центрофугират в рамките на 15 минути и плазмата се отделя и замразява при - 80 ° C, докато се анализира по метод, описан по-рано [5]. Анализът открива промени между съседни проби от 2 fmol инсулин/епруветка с 95% увереност и не показва кръстосана реакция с инсулиноподобните растежни фактори.
Определяне на размера на панкреатичните островчета
В оцветените с H&E диапозитиви диаметърът на приблизително 200 произволно избрани островчета/панкреаса се измерва с микромащаб, използвайки микроскоп Zeiss Axiomat® (Zeiss, Йена, Германия). Средната стойност се счита за размера на островчетата, изразени μm 2 и изчислени съгласно следната формула: площ = π x (дължина a/2) x (дължина b/2).
Определяне на броя на бета-клетките и алфа-клетките в островчетата
Проведено е имунохистохимично изследване по метода на авидин-биотин-пероксидазен комплекс (ABC) [6]. В процеса на оцветяване бяха използвани миши анти-инсулинови моноклонални антитела и заешки анти-глюкагон поликлонални антитела (Zymed Laboratories Inc., Южен Сан Франциско, Калифорния, САЩ). Извършено е двойно имунооцветяване (за инсулин и глюкагон), както се съобщава [7]. След това броят на бета-клетките и алфа-клетките в приблизително 200 островчета беше преброен произволно. Средният размер на островчетата и броят на инсулиновите и глюкагоновите клетки се разглеждат като представителни стойности за всеки панкреас.
Определяне на синтеза на ДНК в панкреатичните клетки
Използвайки анти-бромодезоксиуридин (BRDU) антитяло (Sigma Chemical Co, Сейнт Луис, Мисури, САЩ), бе определено маркирането на ацинарни, дуктални и островни клетки, както се съобщава [8]. Преди прилагането на антитялото (Becton Dickinson, Columbus, NE, USA) в разреждане 1: 100, срезовете се инкубират в 2N HCI за 30 минути при 37 ° С. Слайдовете бяха оцветени с еозин. За определяне на индекса на етикетиране (LI) се отчитат най-малко 100 островчета, 10 000 ацинарни клетки, дуктуларни клетки и възможно най-много дуктални клетки (при хамстери големи канали се виждат само от време на време). Само ядрата на островни клетки с типична кръгла форма и най-малко пет зърна на ядро се считат за маркирани.
Анализ на фекалните мазнини
Фекалиите се събират и оцветяват за мазнини съгласно методите на Drummey [9] и Fine и Ogunji [10] с малки модификации. Накратко, малко количество изпражнения се поставя върху предметно стъкло и се добавят две капки 36% оцетна киселина. Още едно стъкло беше поставено отгоре и съдържанието беше хомогенизирано чрез смилане между двете стъкла, след което бяха добавени две капки 1% Sudan III® (Rowley Biochemical Inc., Danvers, MA, USA). Слайдовете се държаха на ръка върху котлон, докато се появиха мехурчета. След това предметните стъкла бяха бързо отстранени и повторно загряти още два пъти и изследвани микроскопски. Мастните капчици се появиха като червен материал.
ПРОУЧВАНЕ НА ПРОУЧВАНЕ
А. Пилотно проучване
Намиране на обхвата на дозата
За да се идентифицира максимално поносимата доза, бяха приготвени различни концентрации на FPE. Вкусността и токсичността на тези ензими са изследвани в група от 40 женски сирийски златни хамстера.
Разтворимостта на FPE се изследва чрез разреждането му в 40 ml чешмяна вода. Това количество съответства на обема, който се консумира ежедневно от хамстерите. Най-високата концентрация на FPE, която може да бъде напълно разрешена в чешмяна вода, се изчислява в грамове (g) и се дава на килограм (kg) от телесното тегло (BW). Това изчисление беше важно, тъй като искаме да храним FPE въз основа на телесното тегло, което се променя с течение на времето. Следователно, това би ни позволило да увеличим количеството FPE, докато животните наддават на тегло. Установено е, че 2 g/kg е максималното количество FPE, разтворимо във вода. Тридесет женски хамстера бяха разделени на три групи за лечение с по 10 животни всяка. Една група получи FPE в чешмяна вода в максимална концентрация (висока доза: 2 g/kg BW); втората група получи половината от дозата (средна доза: 1 g/kg телесно тегло), а третата група - една четвърт от дозата (ниска доза: 0,5 g/kg телесно тегло). Десет хамстера служеха за контроли и получаваха само чешмяна вода. Ежедневният прием на вода и храна, телесното тегло и физическите дейности на всички животни се записват в продължение на 21 дни.
След 21 дни всички животни бяха евтаназирани и сърцето, черният дроб, бъбреците и панкреаса бяха претеглени и кръвта им беше изследвана за инсулин. Четири часа преди аутопсията BRDU се инжектира на всички хамстери два пъти в доза от 5 mg/kg BW за изследване на ДНК синтеза (индекс на етикетиране) в островни клетки.
Б. Ефект от дългосрочното лечение на гъбични панкреатични ензими (FPE)
За да изследваме дългосрочния ефект на FPE, използвахме два различни FPE препарата: FPE самостоятелно и FPE плюс химотрипсин (FPE + chy), за да проучим дали ефектът се различава между видовете ензимни комбинации.
Експериментален дизайн
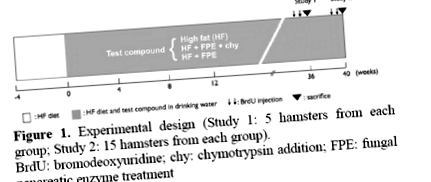
Шестдесет женски сирийски хамстери са били хранени с високо съдържание на мазнини (HF) през целия живот, когато са били на възраст от шест седмици. Четири седмици след започването на СН диетата, когато периферната инсулинова резистентност се развива със сигурност, хамстерите бяха разделени на три групи от по 20 животни. Една група се третира с FPE в чешмяна вода в концентрация 2 g/kg BW (HF + FPE Group). Втората група получи същата концентрация на FPE, съдържаща химотрипсин (HF + FPE + chy Group; количеството химотрипсин не беше посочено от компанията), а третата група получи само вода (Контрол: HF Group) (Фигура 1). Пет хамстера от всяка група бяха жертвани на 36-та седмица (проучване 1), а останалите 15 хамстера на 40-та седмица (проучване 2). Преди жертвоприношението BRDU се инжектира на всички хамстери два пъти в доза от 5 mg/kg BW за изследване на ДНК синтеза (индекс на етикетиране) в островни клетки. Концентрацията на FPE се коригира в зависимост от телесното тегло, което се проследява ежеседмично заедно с количеството вода и консумацията на храна.
Фигура 1. Експериментален дизайн (Проучване 1: 5 хамстера от всяка група; Проучване 2: 15 хамстера от всяка група).
BrdU: бромодезоксиуридин; chy: добавяне на химотрипсин; FPE: лечение на гъбични панкреатични ензими
Бяха определени телесното тегло, количеството вода и прием на храна, нивата на инсулин в плазмата, размерът на островчетата и броят на отделните островни клетки, както и индексът на етикетиране на островните клетки. Степента на съдържание на мазнини в изпражненията, която се събира веднъж седмично, се оценява чрез субективна полуколичествена скала като -, +, ++ и +++. За нивото на инсулин в плазмата и размера на островчетата бяха използвани и нашите архивни данни за хамстери с търговска храна (NP Group).
СТАТИСТИКА
Данните са показани като средно и стандартно отклонение (SD). Статистически анализ за телесно тегло, консумация на храна и прием на вода бяха извършени с помощта на ANOVA. Ако се появят някакви съществени разлики, ние проведохме теста на Tukey-Kramer. Броят на изследваните параметри (т.е. островче), а не броят на животните се счита за размер на извадката при всички изчисления. Например, за размера на островчетата, размерът на пробата е 200 островчета/панкреаса. MATLAB (версия 7.10.0, The MathWorks Inc., Natick, MA, 2010) беше използван като статистически пакет. Две опашни стойности на Р по-малко от 0,05 се считат за статистически значими.
ЕТИКА
Поддържането и хуманното отношение към животните, участващи в това предложено проучване, следваха насоките на Институционалния комитет за грижи и употреба на животните (IACUC) към Медицинския център на Университета в Небраска (UNMC) и всякакъв дискомфорт и нараняване на тези животни бяха ограничени до това, което е неизбежно при провеждането на научно ценни изследвания. Методът за евтаназия е в съответствие с препоръката на Американската ветеринарномедицинска асоциация (AVMA) насоки за евтаназия. Хамстерите, показващи признаци на болка, бяха жертвани от CO2.
РЕЗУЛТАТИ
А. Пилотно проучване
Тежести на тялото и органите
Телесното тегло, оценено в края на експеримента в групата със средни дози (121,6 ± 11,5 g), е значително по-ниско (P = 0,014) от това на контролната група (138,6 ± 17,1 g), докато няма значителни разлики с контролната група установено по отношение на групите с високи дози (152,0 ± 45,0 g, P = 0,052) и ниски дози (138,2 ± 8,0 g, P = 0,056). В допълнение, телесното тегло на групата със средни дози също е значително по-ниско от това на групата с ниски дози (P = 0,051).
Средното тегло на панкреаса е значително по-малко в групата с високи дози (0.770 ± 0.268 g), отколкото в останалите групи (средна доза: 1.146 ± 0.268 g, P = 0.023; ниска доза: 1.356 ± 0.268 g, P 2; P 2; P = 0,016), отколкото в контролната група (169,1 ± 96,1 μm 2). Въпреки че размерът на островчетата в групата с ниски дози (171,7 ± 96,9 μm 2) е по-голям, отколкото в контролната група, разликата не е статистически значима (P = 0,542; Фигура 2).
Фигура 2. Размерът на островчетата в сирийските златни хамстери, хранени с различни концентрации на гъбичен панкреатичен ензим (FPE). Данните са показани като средно ± SD. P стойности спрямо контролна група.
ДНК синтез на ацинарни и островни клетки
Въпреки че FPE влияе върху размера на островчетата в групата с високи дози, скоростта на синтеза на ДНК не дава значими данни поради забележителните широки индивидуални вариации в броя на LI. Наблюдавали сме тези вариации в предишните си проучвания, особено в ацинарните клетки, които също се различават значително в рамките на същия панкреас. Същото важи и за плазмените нива на инсулин. Въпреки че LI и нивото на инсулина са по-ниски в групата с високи дози, разликата не достига статистическа значимост. Следователно такива изследвания изискват много по-голям брой животни за събиране на по-надеждни данни.
Индекс на етикетиране на ацинарни клетки
Във всички групи, с изключение на групата с високи дози, LI на ацинарните клетки е значително по-висока, отколкото в контролната група (0.950 ± 1.184) (т.е. средна доза: 1.910 ± 3.854, P = 0.018; ниска доза: 1.680 ± 2.399, P = 0,007). Въпреки че LI е по-висока в групата с високи дози (1.000 ± 1.318), отколкото в контролната група, разликата не е значителна (P = 0.869; Фигура 3).
Фигура 3. Индекс на етикетиране на ацинарни клетки при сирийски златни хамстери, хранени с различни концентрации на гъбичен панкреатичен ензим (FPE). Данните са показани като средно ± SD. P стойности спрямо контролна група.
Индекс на етикетиране на островни клетки
Във всички групи LI на островните клетки е по-ниска, отколкото в контролната група. Разликите обаче не са значителни (висока доза: P = 0,649; средна доза: P = 0,410; ниска доза: P = 0,542; спрямо контролната група) (Фигура 4 и Таблица 1).
Фигура 4. Индекс на етикетиране на островни клетки при сирийски златни хамстери, хранени с различни концентрации на гъбичен панкреатичен ензим (FPE). Данните са показани като средно ± SD. P стойности спрямо контролна група.
Ниво на инсулин
Не са открити значителни разлики между нивата на инсулин в плазмата на третираните групи и нивото на контролната група (1.255 ± 0.857 ng/mL). По-специално, в групата с високи дози плазмените нива на инсулин са по-ниски (0.948 ± 0.270 ng/ml, P = 0.318); в групата със средни дози беше по-висока (1.507 ± 1.078 ng/mL, P = 0.613), а в групата с ниски дози - по-ниска (0.720 ± 0.250 ng/mL, P = 0.167), отколкото в контролната група (Фигура 5).
Фигура 5. Ниво на плазмен инсулин при сирийски златни хамстери, хранени с различни концентрации на гъбичен панкреатичен ензим (FPE). Данните са показани като средно ± SD. P стойности спрямо контролна група.
Б. Ефект от дългосрочното лечение на гъбични панкреатични ензими (FPE)
Прием на вода и храна
HF + FPE + хамстери, хранени с chy, консумират по-малко вода в момент 0 и след 24 и 28 седмици, както и HF + FPEfed хамстери консумират по-малко вода в момент 0 и след 12 седмици в сравнение с HF-хранени хамстери. Количеството консумирана вода от групата HF + FPE + chy е значително по-високо от групата HF + FPE след 32 и 36 седмици (Фигура 6). Всички хамстери консумират еднакво количество храна (Фигура 7).
Фигура 6. Ежедневен прием на вода в сирийски златни хамстери, хранени с високо съдържание на мазнини (HF) и третирани с гъбичен панкреатичен ензим (FPE), с и без добавяне на химотрипсин. Линията в полето показва медианата (50-ия перцентил), а дъното и горната част на полето съответно 25-ти и 75 процентила от разпределението (интерквартилен диапазон). Мустаците се простират до максималната и минималната наблюдавана стойност. * Значителна разлика (P
- У дома
- относно
- Списания
- Статии
- Редактори
- Автори
- Рецензенти
- Свържете се с нас
- Ефекти на физическата активност върху чернодробната функция при пациенти с безалкохолна мастна чернодробна болест А
- Хроничното излагане на етанол затваря вратата към витамин С в ацинарните клетки на панкреаса
- Повишената циркулираща стеаринова киселина води до основен липотоксичен ефект върху бета клетките на панкреаса на мишки
- EPI и панкреатични ензими Q; A с Експерт - Мисия Cure
- Повишената циркулираща стеаринова киселина води до основен липотоксичен ефект върху бета клетките на панкреаса на мишки